近年来,复宏汉霖一直保持着高歌猛进的姿态,不断加速产品的研发进度,逐渐构画起一幅庞大的生物制药版图。去年2月,汉利康获批,实现了国产生物类似药零的突破,也推动公司正式开启商业化转型之路。
APP了解到,8月14日,复宏汉霖-B(02696)自主研发的核心产品曲妥珠单抗汉曲优®(HLX02,欧盟商品名:Zercepac®)正式获得国家药监局(NMPA)批准上市,用于治疗HER2阳性的早期乳腺癌、转移性乳腺癌和转移性胃癌。此前,汉曲优®(欧盟商品名:Zercepac®)已于今年7月正式获欧盟委员会(EC)批准,成为首个登陆欧洲市场的“中国籍”单抗生物类似药。
这是复宏汉霖创立以来第二款获批上市的产品,也是首个获批上市的国产曲妥珠单抗生物类似药。
一直以来,复宏汉霖在抗HER2产品的开发与布局都在国内保持相对领先状态,随着汉曲优®在国内外获批上市,复宏汉霖研发能力和商业化的可持续性也进一步得以验证,无疑赋予了公司更高的内在价值。在此关键节点,投资者可从国内市场空间,以及公司国际开发和商业化优势等角度,深入了解复宏汉霖巨大的升值潜力和明朗的投资前景。
庞大的未满足需求和市场增长潜力
生物医药投资的重要逻辑,在于研判公司对创新研发的投入力度,以及研发成果转化后的目标市场体量与占有能力。在此背景下,生物医药细分赛道的容量大小,也在一定程度上决定了公司的成长空间,同时也决定了投资者对公司的想象高度。
APP了解到,乳腺癌分别位居我国女性恶性肿瘤发病率和死亡率的第1位和第5位,而HER2阳性乳腺癌占全部乳腺癌患者的20%以上,患者群体庞大。中国新增乳腺癌病例预计将由2018年的约32.07万例增至2030年的约37.32万例。而在胃癌方面,中国胃癌新增病例则将由2018年的44.23万例增至2030年的61.38万例。
曲妥珠单抗是国际医学界一致推荐的HER2阳性乳腺癌和胃癌的标准治疗用药。APP了解到,原研曲妥珠单抗 (赫赛汀)是罗氏旗下最畅销的肿瘤产品之一,2002年进入中国,不过其药价对国内普通患者并不“友好”。
在汉曲优®获批之前近二十年时间内,国内上市的曲妥珠单抗仅有赫赛汀,庞大的治疗市场为罗氏带来了丰厚的利润,2018年赫赛汀在中国境内的销售额达到27亿元。
2017年7月,赫赛汀被纳入国家医保目录乙类范围,价格定为7600元;价格降低之后,赫赛汀虽然让更多乳腺癌患者可负担,也意味着药品放量急剧增加,随之而来的便是药品短缺问题。
资料显示,赫赛汀纳入医保之后,一度出现全国性缺货现象,部分患者被迫断药。在此背景下,国内急需国产曲妥珠单抗出现,增加抗HER2治疗选择,并保障稳定供货来源。
这一层面上,汉曲优®的获批上市意义非凡,不仅增加了医生的用药选择,有望满足了国内HER2阳性乳腺癌和胃癌患者庞大且迫切的用药需求,还有助于增强市场的良性竞争,节省国家医保支出。
当然,汉曲优®获批上市,其意义不仅于此,还有望极大增厚复宏汉霖的利润空间。据APP了解,2020年,国内赫赛汀类似药市场规模仅有8亿元,但到2030年预计将达到73亿元。巨大的市场开发潜力,让复宏汉霖的价值曲线得到进一步攀升。
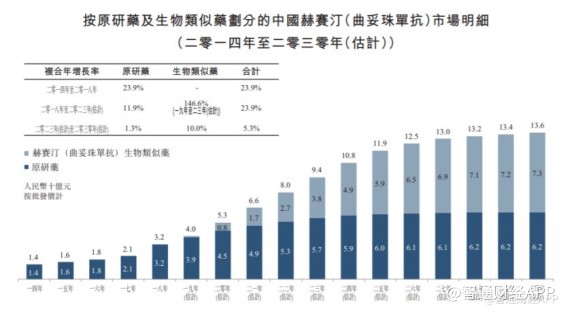
目前汉曲优®作为唯一上市的国产曲妥珠单抗,已处在国内赫赛汀类似药市场领先地位,且按照生物类似药平均审批时间来看,汉曲优®相比其他仍处于临床研究阶段的赫赛汀类似药至少具有1年半到2年的先发优势。
随着上市后国产替换进程不断加速,可以预见汉曲优®市场开发潜力巨大。这无疑将成为继汉利康之后,复宏汉霖开辟的又一片“变现”蓝海。
国际化开发为汉曲优®全球上市作好铺垫
近年来,复宏汉霖在不断丰富产品管线的同时,还积极推进国际化开发布局。正是得益于颇具前瞻性的高水平国际化战略布局,汉曲优®才能同时在国内外加速落地。
APP了解到,复宏汉霖建立了高效的一体化全球研发平台,公司分别在台北、上海及加州建立了三大研发中心,这三大研发中心密切合作,高效推动研发进展且兼顾成本效益。凭借多年的积累,复宏汉霖目前在海外的药政注册能力、临床开发和运营能力,可支持公司在全球多个地区开展临床试验。
其中,汉曲优®便是首个开展国际多中心III期临床研究的国产生物类似药。该临床试验结果在2019年于新加坡举办的ESMO Asia年会上发布。
研究证明了在HER2阳性复发或转移性乳腺癌患者中,HLX02(汉曲优®)和原研曲妥珠单抗(欧洲市售)24周的最佳总缓解率组间差异95%置信区间在预设的等效区间内,两治疗组疗效等效性成立。
截止到数据截止日,所有HLX02(汉曲优®)的次要疗效和安全性分析结果均支持HLX02(汉曲优®)与原研曲妥珠单抗(欧洲市售)在既往未经治疗的复发性或转移性HER2阳性乳腺癌患者中生物相似性成立。
更值得一提的是,汉曲优®还是国内首个中欧双报的生物类似药,其开发过程前瞻性地按照中国和欧盟的生物类似药指导原则进行。
2020年4月,复宏汉霖顺利通过HLX02(汉曲优®)原液(DS)和制剂(DP)线的欧盟GMP现场核查,正式获得波兰卫生监督机构签发的两项欧盟GMP证书,这充分说明复宏汉霖已经具备了符合欧盟标准的商业化生产基地和质量管理体系。
5月31日,公司发布公告称,欧洲药品管理局(EMA)人用药品委员会(CHMP)对HLX02(汉曲优®)在欧洲的上市申请(MAA)给予了积极审评意见,建议批准其上市销售许可申请。根据审评流程,CHMP的积极审评意见被递交至欧盟委员会(EC)。
7月29日,复宏汉霖宣布,欧盟委员会正式批准公司自主开发和生产的HLX02(曲妥珠单抗,欧盟商品名:Zercepac®)于欧盟上市。复宏汉霖自主研发和生产的高品质生物药,获得国际权威药监机构的高度认可。
此后,HLX02(汉曲优®,欧盟商品名:Zercepac®)即可在全部欧盟成员国,以及欧洲经济区国家挪威、冰岛和列支敦士登上市销售,成为进入欧洲市场的第一个“中国籍”单抗生物类似药。
构建国际化商业体系 规模变现未来可期
生物医药企业若想立足行业之林,不仅需要深厚的研发底蕴和优势的创新产品,商业化策略选择同样是不容忽视的关键环节。
如今,汉曲优®在国内正式落地,从公司对产品的国际化商业布局切入,有助于投资者对汉曲优®的变现预期以及复宏汉霖的升值潜力深入了解。
针对汉曲优®在国内外市场的商业运营,复宏汉霖采取了创新的商业化策略。在国内市场,复宏汉霖选择全面布局,在追求一二线城市市场份额的同时,不断加大在三线城市及以下基层市场的布局;在国际市场,复宏汉霖则选择与国际知名药企合作,借助其分销渠道,将产品销往欧盟及新兴国家市场,惠及全球更多病患。
APP了解到,2019年中国处方药排名前10的榜单中,赫赛汀销售额增速由2018年的59.3%进一步提升至67.2%,成为中国销售额排名第六的处方药。
赫赛汀销售增速,核心原因在于曲妥珠单抗进入医保后,三、四线城市能够承担用药费用的患者人数增长强劲。正如复宏汉霖总裁张文杰所提到,2019年中国市场的曲妥珠单抗销售增长,估计一半来自三线以下城市。
在公司发布的2019年业绩报告中提到,针对HLX02(汉曲优®)的国内市场,复宏汉霖计划于2020年搭建起超过500名专业人士组成的高效团队,旨在覆盖全国6大销售区域内260余个1线到3线城市的2700多家甲/乙等医院。与传统的覆盖三级以上核心医院的商业化策略不同,快速切入三线及以下城市的基层医院渠道,有望在基层增量市场展开有利竞争。
在快速切入国内市场的同时,汉曲优®的国际化商业布局也在稳步推进。
复宏汉霖已针对汉曲优®前瞻性地开展了国际商业化布局,积极开拓海外市场。公司分别与Accord、Cipla、Mabxience和雅各臣药业等国际一流的生物制药企业达成合作,促进汉曲优®在全球80多个国家和地区的商业化进程。
其中Accord是一家全球性制药公司,专注于仿制药产品和生物仿制药的开发、制造和销售,业务覆盖北美、欧洲、澳洲、南非等地区。2018年6月下旬,复宏汉霖与Accord签订合作协议,授权其在欧洲地区包括英国、法国、德国和意大利等在内的53个国家,中东及北非地区17个国家和部分独联体国家对汉曲优®进行独家商业化开发。
该协议可以让复宏汉霖借助Accord分销渠道快速进入欧洲市场。汉曲优®(欧盟商品名:Zercepac®)在欧盟的顺利获批上市即为复宏汉霖与Accord携手推动的结果,其后续在欧洲的商业化也将由Accord负责。
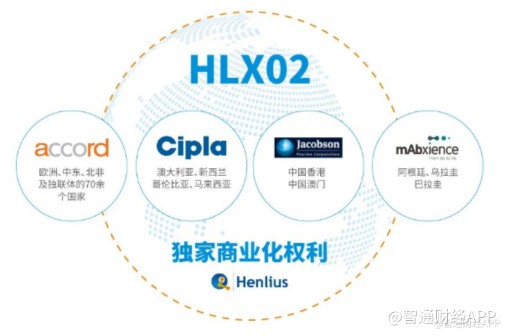
今年3月31日,复宏汉霖宣布与全球性生物技术公司Mabxience签订独家许可协议,授予其在阿根廷、乌拉圭及巴拉圭针对汉曲优®在肿瘤治疗领域的开发及商业化独家权利,借助Mabxience在南美洲的既有资源,复宏汉霖能够进一步加快汉曲优®的国际化进程,惠及更多新兴市场国家的患者。
综上所述,不论从汉曲优®的国内推广营销还是国际化商业布局的筹备方面,复宏汉霖都已准备就绪。可以说,当前已获批上市的汉曲优®距离规模化变现的目标仅一步之遥。随着未来市场空间不断提升,以及产品商业化进程的持续推进,汉曲优®定将为复宏汉霖带来持续且丰厚的利润回报。











 还未登录
还未登录